- Complete la tabla:
Símbolo
|
P+
|
e-
|
No
|
Z
|
A
|
Ga
|
|||||
Zr
|
|||||
K
|
|||||
P
|
- Escriba la configuración electrónica del rubidio (Z = 37) ¿Qué tipo de enlace formará con el flúor (Z = 9)?
A)
Las sustancias puras son aquellas que están formadas por un solo tipo de átomos.
B)
Ernest Rutherford estuvo trabajando con el tubo de rayos catódicos y dedujo
la
masa y la carga del electrón.
C)
La masa atómica decimal de ciertos elementos se debe a que, al sumar la masa
de
los electrones, se obtienen valores decimales.
D) La molécula Pb3(PO4)2 contiene un total de 13 átomos.
4. Indique el número de átomos de cada tipo que hay en cada molécula:
a) H2O, b) FeCl2, c) CuSO3, d) SbO2, e) (NH4)2S
5. Escriba la configuración electrónica de los
siguientes elementos e indica cuántos electrones
externos posee cada uno y de que elemento se trata: Z=22; Z=30, Z=37, Z=53.
6. Indique el número de protones, neutrones y electrones que presentan estos átomos:
a) 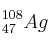 ; b)
; b) 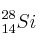 ; c)
; c) 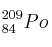 ; d)
; d) 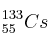
7. Complete la tabla:

8. Basándose en el modelo de átomo de Bohr, razone si son
verdaderas o falsas las siguientes afirmaciones:
a) El núcleo atómico es neutro.
b) Los electrones giran alrededor del núcleo a
velocidades próximas a la de la luz.
c) La corteza del átomo es negativa.
d) Los electrones giran alrededor del núcleo
en cualquier dirección y en cualquier
posición del espacio.
e) El número de electrones y el de protones es
igual en un átomo.
f) El número de neutrones es igual al de
protones en cualquier átomo.
9. Resuma las características
principales de los modelos atómicos de:
Bohr, Thompson y Rutherford.
- El descubrimiento de partículas como el protón y el neutrón produjeron la crisis del modelo atómico de Thomson. ¿Qué experimento realizó Rutherford que supuso la creación de un nuevo modelo atómico? ¿Por qué?
- Escriba la configuración electrónica de los siguientes átomos: Na (Z = 11), S (Z = 16), Cu (Z = 29) y F (Z = 9).
13. ¿Qué es un hidróxido? ¿Cómo se obtiene?
14. Mencione las propiedades características de los óxidos definidos y de los hidróxidos.
15. ¿Qué es una sal? ¿Cuales son sus propiedades? ¿Cómo se obtienen?
16. ¿Cuáles son los factores que, por su acción combinada, producen la oxidación de la mayoría de los metales?
17. ¿Qué es la corrosión?
18. Comente brevemente las características de la tabla periódica? Grupos, períodos y características generales.
19. Explique por medio de que reacciones químicas espera obtener estos compuestos (Indique su nomenclatura):
a) Na2O, b) Cl2O5, c) KOH, d) MgO, e) Fe2O3, (Realice el balanceo de cada reacción)
20. ¿Qué entiende por isótopos? De por lo menos 3 ejemplos.
21. ¿Es lo mismo reacción química que ecuación química? ¿Por qué?
22. Explique el concepto teórico "Configuración electrónica de los elementos"
23. Investigue que factores modifican la velocidad de una reacción química.
24. ¿Qué significa que un átomo sea eléctricamente neutro?
25. ¿Cómo mantienen su estabilidad los átomos?
26. ¿Qué es un ión? ¿Cómo pueden ser los iones?
27. ¿Qué son las fuerzas intermoleculares?
28. ¿Qué tipo de unión se forma entre el sodio, que es un metal, y el cloro, que es un no meta, para obtener el cloruro de sodio? ¿Por qué?
29. ¿Qué tipo de unión se forma entre el oxígeno, que es un no metal, y el carbono, que es otro no metal, al obtener el dióxido de carbono? ¿Por qué?
30. Mencionen algunos ácidos, hidróxidos y sales comunes en la vida diaria. ¿Qué utilidad tiene cada uno?
31. ¿A qué se denomina reacciones irreversibles y reversibles?
32. Considera que el descubrimiento de la radiactividad fue totalmente casual ¿Por qué?
33. Explique qué sucede durante una reacción química, indique todos sus componentes.
34. Defina reacciones exergónicas y endergónicas.
35. Defina reacciones exotérmicas y endotérmicas.
36. Proponga el término correspondiente:
b)Reacción química que se produce con liberación de calor.
c)Primer elemento químico empleado como unidad de masa atómica.
d)Sustancias que se transforman durante una reacción química.
37.
Balancee las siguientes ecuaciones químicas:
a) Cu +
O2 ------ CuO
b) CO + H2 -------CH3OH + calor
c) Zn + HCl ------ZnCl2 +H2
38. ¿Cuál
de las siguientes reacciones está mal balanceada? Corregirla según corresponda y
coloque los nombres de los reactivos y de los productos debajo de cada uno en
ambas ecuaciones:
a)
2Cl2 +
Na ---------- 2 NaCl
b)
4Fe +
3º2 ---------- 2Fe2O3
39. Defina los siguientes términos: Catión, anión, orbital, electronegatividad, uniones iónicas, covalentes y metálicas.
40. Complete la siguiente tabla:
Elemento
químico
|
A=19
Z =9
|
A=40
Z=18
|
A=24
Z=12
|
A=20 Z=10
|
Nombre
del elemento
|
||||
Número
másico
|
||||
Número
atómico
|
||||
Número
de protones
|
||||
Número
de electrones
|
||||
Número
de neutrones
|
||||
¿Formará
anión o Catión? O es inerte.
|
||||
Tipo de
unión química con O2
|
41. ¿En qué consiste la Ley de la conservación de la masa? ¿Por quién fue enunciada?
42. ¿A qué se denomina entalpía? ¿Cómo es la entalpía en las reacciones, según absorban o eliminen calor?
43. Cuando reacciona un trozo de cinta de magnesio (Mg) con oxígeno se obtiene un sólido en polvo (MgO)
a) Escriba la reacción química correspondiente.
b) Si medimos la masa de magnesio que reaccionó y la del sólido en polvo obtenido comprobamos que no son iguales. Justificá está afirmación.
44. Marque con una cruz las reacciones que se encuentran balanceadas y ajuste las que no lo estén:
a) Ca + O2 ------- CaO
b) HCl + Zn ------ZnCl2 + H2
c) 2H2 + O2 ---- 2H2O
d) C + O2 ------ CO2
45. Realice una redacción con amplio contenido científico explicando los conceptos del sencillo mapa conceptual y sus relaciones.
46. Indicar los símbolos de los siguientes
elementos:
a. Cálcio
f. Plata
k. Azufre
p. Bromo
u. Helio
|
b. Neón
g. Níquel
l. Potasio
q. Cinc
|
c. Aluminio
h. Radio
m. Magnesio
r. Hierro
|
d. Mercurio
i. Fósforo
n. Litio
s. Cloro
|
e. Oro
j. Nitrógeno
o. Arsénico
t. Estaño
|
47.Dados
los siguientes símbolos, indicar el nombre
del elemento que representan:
del elemento que representan:
a. Li
g. F
m. Sr
|
b. Be
h. Pb
n. Mn
|
c. Mg
i. Ca
o. C
|
d. O
j. B
p. Na
|
e. Zn
k. Al
q. Cr
|
f. S
l. Si
r. H
|
48.
Indicar cuántos protones, neutrones y electrones tiene
cada uno de los siguientes átomos:
cada uno de los siguientes átomos:
75 AS 33
7 N 15
|
52 Cr 24
6 C 12
|
80 Br 35
6 C 14
|
49.
¿Por qué hay dos átomos de nitrógeno y dos de carbono?.
50. Completar la
siguiente tabla:
Elemento
|
Z
|
A
|
Protones
|
Neutrones
|
Electrones
|
Cl
|
17
|
35
|
|||
B
|
11
|
3
|
|||
Ne
|
20
|
10
|
|||
Mo
|
54
|
42
|
|||
Bi
|
209
|
126
|
|||
Cs
|
55
|
133
|
|||
P
|
16
|
15
|
|||
Co
|
17
|
59
|
|||
Mg
|
24
|
12
|
51 ¿Qué relación
existe entre un grupo de la clasificación
periódica y el número de electrones de la última capa
de los átomos de elementos pertenecientes al mismo?
periódica y el número de electrones de la última capa
de los átomos de elementos pertenecientes al mismo?
52 ¿Cuáles
son los elementos anfóteros?
53¿Qué
es un grupo?
54
¿Cuántos grupos hay?
55
¿Qué es un período?
56
¿Cuántos períodos hay?
57
¿Qué tienen en común los elementos de la tabla
periódica que están colocados en la misma columna?
¿Y los que están colocados en la misma fila?
periódica que están colocados en la misma columna?
¿Y los que están colocados en la misma fila?
58
¿Qué criterio es el utilizado para ordenar los
elementos en la tabla periódica? ¿Siempre ha sido así? Explique
elementos en la tabla periódica? ¿Siempre ha sido así? Explique
59 Defina a continuación el concepto de ACIDOS y
BASES,
y cuál es su relación con el Ph
y cuál es su relación con el Ph
60 En relación a la investigación anterior
clasifique
las siguientes sustancias.
las siguientes sustancias.
a) Vinagre
b) Leche
c) Líquido limpiador para
baños
d) Jugo de tomate
e) Jugo de naranja
f) Bebida gaseosa
g) Agua de canilla
h) Champú
i) Yogurt bebible
FECHA LIMITE DE ENTREGA SEMANA DEL
18 AL 22 DE NOVIEMBRE DE 2013
18 AL 22 DE NOVIEMBRE DE 2013

